定各段階のpHか ら(7)お よび(7')式 におけるx, 「を計算し,X,「 を両軸にとって求めた値を点綴し ρ て各点を結ぶ最適の直線を決定し,こ れから濃度C1,Cg を求めた。計算に使用する各酸の解離定数はそれぞれつ ぎの値を用いた。 ギ酸K=1・765×104(0C)5),酢 酸K1753×,標準液は、溶液の安定したpHを維持するために使われます。 これは、弱酸とその共役塩基、または弱塩基とその共役酸を混合して生成します。 正確な標準溶液の使用は多くの化学分析や生化学分析に不可欠です。 標準液を調製する場合には成分を厳密に計量することが重要です。 計算方法も知りたいです ②pH7の水00Lを35%塩酸にてpH1に調整する時、35%塩酸の必要量はいかほどか。計算方法も知りたいです。 ※溶液は水酸化ナトリウム1500㍑と次亜塩素ナトリウム500㍑の混合液です。 お願いします。

兩溶液混合後m之計算1 42閃 Youtube
Ph 計算 混合 ツール
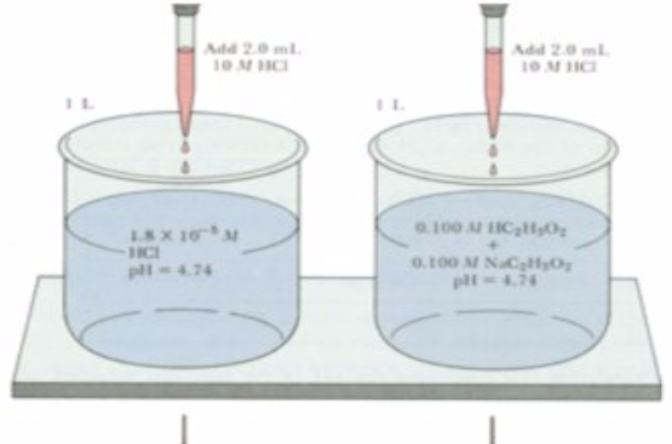
Ph 計算 混合 ツール-PH、pKa、Ka、pKb、Kbを説明 溶液中の酸性または塩基性の程度と 、酸および塩基の強 さを測定するために使用される化学に関連するスケールがある。 pHスケール は最もよく知られていますが、pKa、 Ka 、 pKb 、Kbは 酸塩基反応の 洞察を提供する一般的な計算H 2 O ⇔ H + OH K W = H OH = 10×10 14 (25℃) 溶液がアルカリ性ですので,pHを決めているのは主として水酸化物イオンOH です.水素イオンの濃度は従属的に決まっているだけです.したがって,混合前の水酸化物イオンの濃度から混合後(体積変化)の水酸化物イオンの濃度を求め,それからpHを求める必要があります.最後の答えはpH=984になると思います




第二课时溶液ph的计算 Ppt Download
010mol/LのNH 4 Cl溶液のpHを求めよ。 ただし、アンモニア (Kb = 18×10 -5)とする。 NH 4 Clは塩なので完全に電離する。 H + >> OH - 、 Ca >> H + であると仮定する。求まるので、pHも計算できることになる。 では、具体的に計算してみることにしたい。例として、濃度が共に010mol/l であるギ酸(酸解離定 数2£10¡4 mol/l)と酢酸(酸解離定数275£10¡5 mol/l)の混合水溶液の場合は、(9)式から、pHは 226 となる。 pH計算の公式 公式1pH = log10 H 公式2pOH = log10 OH– 公式3 H OH– = 10×1014 公式4pH pOH = 14 公式5 H = c×m×α(c:溶液のモル濃度、m :価数、α:電離度) 公式6 OH = c×m×α(c:溶液のモル濃度、m :価数、α:電離度) 強酸・弱酸のpHの求め方 「強酸」
pH = − log(10 × 10 ー 13) = 13PH的計算公式如下: = = 其中H 指的是溶液中氫離子的活度(有時也被寫為H 3 O ,水合氫離子活度),單位為莫耳/升,在稀溶液中,氫離子活度約等於氫離子的濃度,可以用氫離子濃度來進行近似計算。 在25°C下,pH=7的水溶液(如:純水)為中性,這是因為水在25°C下自然電離出的氫離い計算をやっていると計算ミスを犯すので,省略できるところは省略するも のなのだ. 32 実際に計算してみる 以上を意識して,ところどころ数値の取り扱いに工夫しながら緩衝溶液の pHをみて行こう. 321 混合溶液のpHを理論計算で求める
PH中和処理制御技術の記事一覧 63 中和滴定曲線 ; 酢酸、酢酸ナトリウム混合溶液のpH計算方法 酢酸、酢酸ナトリウムの平衡反応 酢酸の平衡反応 $$\rm{CH_3COOH H_2O ⇄ CH_3COO^ H_3O^}$$ 酢酸の平衡定数 $$\rm{K_a = \frac{H_3O^CH_3COO^}{CH_3COOH}}$$ 酢酸ナトリウムの平衡反応 $$\rm{CH_3COONa → CH_3COO^− Na^}$$酢酸ナトリウムの混合溶液について次の各 問に答えなさい。 (1) 混合溶液中の酢酸と酢酸ナトリウムの調製時の濃 度がそれぞれ 040 mol/L, 010 mol/L であるとき、 この混合溶液の pH はいく 解決済み 質問日時: 21/6/28 731 回答数: 1 閲覧数: 10



Ph值計算公式酸鹼度 Gjlni




弱酸强碱混合ph计算 弱酸和强碱反应ph计算 酸碱混合溶液ph计算
したがって、phの低下は57 実際に計算してみましょう。 の混合溶液100mLに、NaOHをmol溶解します。このとき、NaOHの溶解液に伴う水溶液の体積変化はないものとして、NaOHを加えた後のpHてか実際の水槽では他の物質が存在したり別の科学反応が起こったりするので、ぶっちゃけどんな風に計算しようと計算通りにはいかないです。 例えば酸性物質を入れても石のカルシウムと反応して全然pH下がらないとか。 なので、pHが計算通りにならない場合がほとんどです。 実際は「あ~全然pH動かないな~」と油断しているとある時点で一気にガツンと傾くPHは以下のように定義されます。 厳密には活量を用いて(活量:ある系の成分iの粒子数/全体の粒子数)計算しますが、一般的に希薄溶液下では溶質の活量は、モル濃度に近似して扱います。 よって、一般的に使用されるpHは以下のように、水素イオン濃度の対数をとってを用いて表されます。 例えば、ある溶液中の水素イオン濃度がH=10^(5) mol/Lであったら、pH=5




高校化学基礎の 混合水溶液のphの求め方がよく分かりません どうして物質量を引き算す Clear




化学分析 第三章 3 3 酸碱ph计算 小库档文库
混合前の濃度をciとする。 溶液1に含まれるときはci0=ciV1/ (V1V2) 溶液2に含まれるときはci0=ciV2/ (V1V2) ※たとえば同量で計算しますと・・・71pHが500Lで90pHが500Lの場合 (71**500)/ =8050/1000 =805pH ∴(7190)/2 =805pH 単位計算でおこなうとこうなります。PH = –log 10H = –log 10(10–2) = 2 (2) pHが2のHCl 500 mLと,pHが3のHCl 500 mLを混合したときのpHを計算せよ. 必要があればlog 1055 = 074とせよ. 両方の水溶液についてHを求め,両者の平均をとる.そこからpHを計算する. それぞれの水溶液のHを




两性物质的ph计算公式两性动态图23式 百姓百科




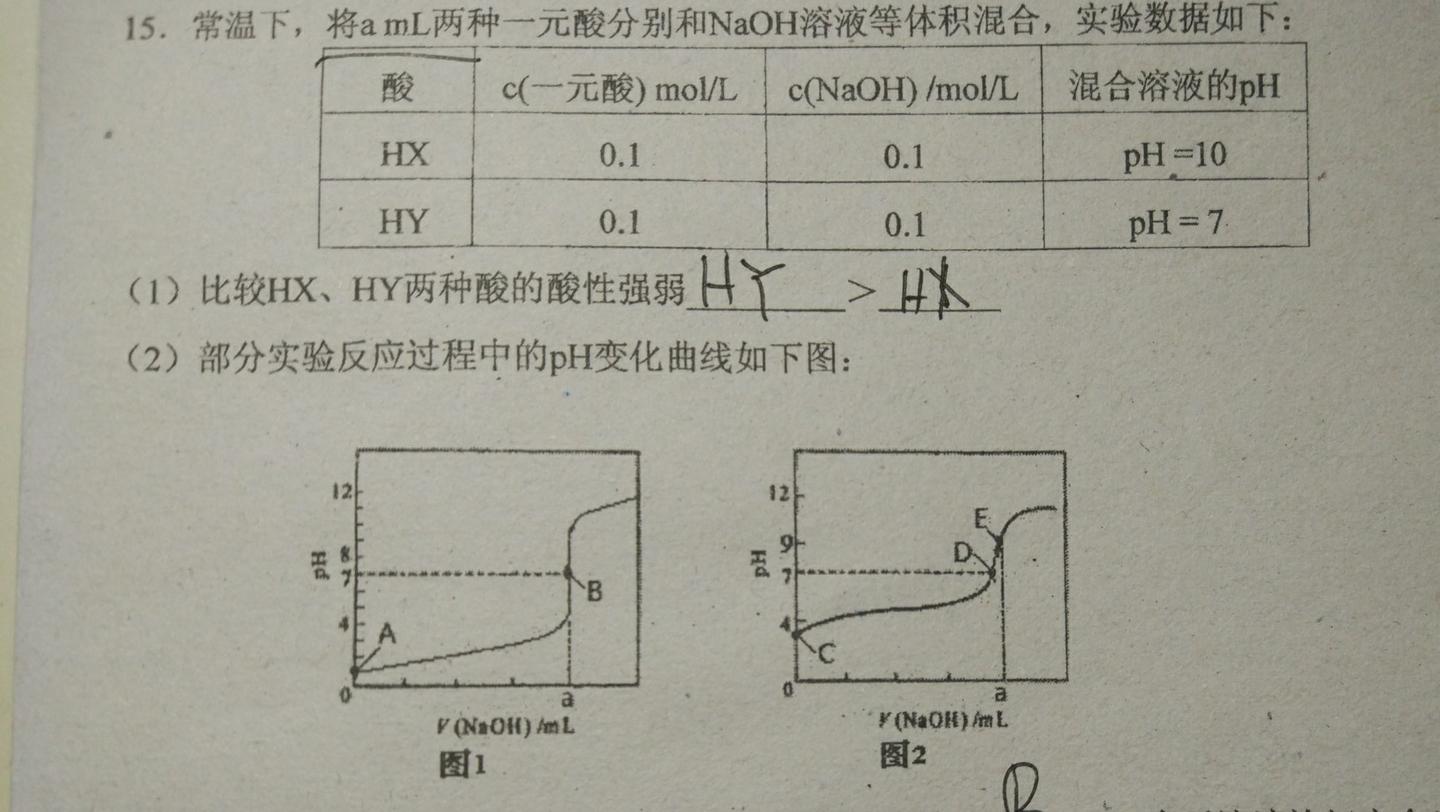
Ph值怎么算 百度经验
計算式に上記の数値を代入すると、 =32 1,000 ようりんの成分%として現物所要量は、32× 100 =160(㎏/10a)ン濃度が計算できるので、混合水溶液のpHを求めることができる。 因みに、 010mol/L の酢酸 ( K a =27 × 10 − 5 mol/L) 100mL に、 ⊙ 010mol/L NaOH 水溶液を加えない場合、 pH=279 pH計算方法 酢酸に限らず、pHの求め方は以下の通りです。 pH = logH 3 O ( pH=logH ) ヒドロニウムイオンH 3 O は、水素イオンH が水和した形です。 水溶液中では水素イオンH はヒドロニウムイオンH 3 O の形で存在していると考えられています。 pHを計算する上では、どっちでもOKです。



弱酸與強鹼的滴定titrations Of Weak Acids With Strong Bases 3 1 加百列的部落格 Udn部落格



弱酸稀释后ph值的计算化学的ph值计算
其他 標題pH值的計算問題 1orzon (大學)張貼 0054 兩個溶液pH值分別為1和6,兩個溶液以等體積混合所得混合液pH值是多少?(log2=030 log3=048) 2黃福坤 (研究所)張貼 回應上一篇 請問你知道PH值的意義嗎?請說明一下以確認你知道其定義 ( 其實 pH = 0 也是正常的 =1) • pH 值可能會小於 0 或大於 14 。 2 • pH 值之範圍介於 0 ~ 14 之間, pH 值= 7 時表中性, pH 值> 7 為鹼性, < 7 為酸性 ; pH 值之單位是用對數表示, pH = 1 其強度就差 10 倍, pH 3 就比 pH 4 酸性強 了 10 倍。薬剤師国家試験 平成30年度 第103回 一般 実践問題 問 332 注射液A(pH34、2 mL/アンプル)、注射液B(pH86、2 mL/アンプル)及び注射液C(pH91、10 mL/アンプル)をシリンジ内で混合する。 薬剤師は各注射液のpH変動スケール(上図)に基づいて薬剤の調製を



常见酸碱混合溶液ph值的近似计算 Cnki学问




高中化學之ph值相差1的兩弱酸稀溶液相關計算問題解析 每日頭條
中和滴定曲線 この章では中和滴定曲線について解説していきます。 中和滴定曲線って? まず、この図を見てください。 これは、酸に塩基を少しずつ加えていった時のpHの変化を表したグラフです。 途中で凄い勢いでpHが上昇している部分があるのが pH=6は水素イオン濃度が1×10^-6 mol/L pH=9は1×10^-9 mol/Lです。 容積1Lの水で仮に考えると、4:1なら800 mL:0 mLです。 水素イオンの量 molを考えると 1×10^-6 mol/L×0.8 L=8×10^-7 mol と 1×10^-9 mol/L×0.2 L=2×10^-10 mol の合計なので 8002×10^-10 molが1L中に含まれていることになります。1×10-7mol/L のHCl ⇒ pH = 7 1×10-9 mol/L のHCl ⇒ pH = 9 この場合の計算法は以下のようにする. 例)HCl 溶液(10×107 mol/L)のpH. (溶液中の平衡) HCl + H2O H3O + Cl- H2O + H2O H3O + OH- (水のイオン積) HOH- = Kw =10×10-14 ①



Http Www Mater Rep Com Fileup 1005 023x Pdf Trans Pdf




強酸強鹼混合話你知 強酸強鹼互溝攞命 Bqony
湿り空気状態値算出 空気状態値をいずれか二つ入力して計算します。 計算結果は複数表示します。 絶対湿度と露点温度はいずれか一方とします。 比エンタルピと湿球温度はいずれか一方とします。 算出値はコピー&ペーストでExcelにそのまま貼り付け次の各間に答えよ。 (1) 040mol/Lの塩酸50mLから生じる水素イオンの物質量を求めよ。 (⑫) mol人 の水際化ナトリウム本党湊50mLから生じる没化物イオンの偽質を (3) 提信したのちの体積は変化しないものとして、混合水深液のpHを求めよ。 1にを当合した05mol/Lの酢酸ナトリウム溶液10mlと02mol/Lの酢酸溶液(pKa= 476)mlを混合した液体のpHを計算します。 C6H5COOH c=02 v= pKa=421 C6H5COONa c=05 v=10 pKb=979 例を解決 4!




师说 15 16学年高中化学3 2水的电离和溶液的酸碱性 第2课时 溶液ph的计算习题新人教版选修4下载 Word模板 爱问共享资料




Ppt 水的电离和溶液的ph Powerpoint Presentation Free Download Id
如何計算pH值和 H 平衡方程式產生下面的公式: pH = log 10 H H = 10 pH 換句話說,pH值是摩爾氫離子濃度的負對數。 或者,氫離子摩爾濃度的摩爾濃度等於負值pH值的10。 在任何科學計算器上 進行這種 計算 很容易,因為它會有一個"記錄"按鈕。 (這與"ln"按鈕不同,它是指自然對54 pH制御 自動化のシステム(計測制御システム) 53 pH制御 pH制御における留意点2化学混合物のpHの計算方法 科学 21 溶液のpH値は、特定の溶液の酸性または塩基性を測定するために使用され、確立されたpHスケール(ゼロから14まで)に従って評価されます。 溶液中のヒドロニウムまたは水素イオンの濃度を使用して計算すると、単一



Ph的计算方法与规律 化学自习室



溶液混合ph计算器 计算器
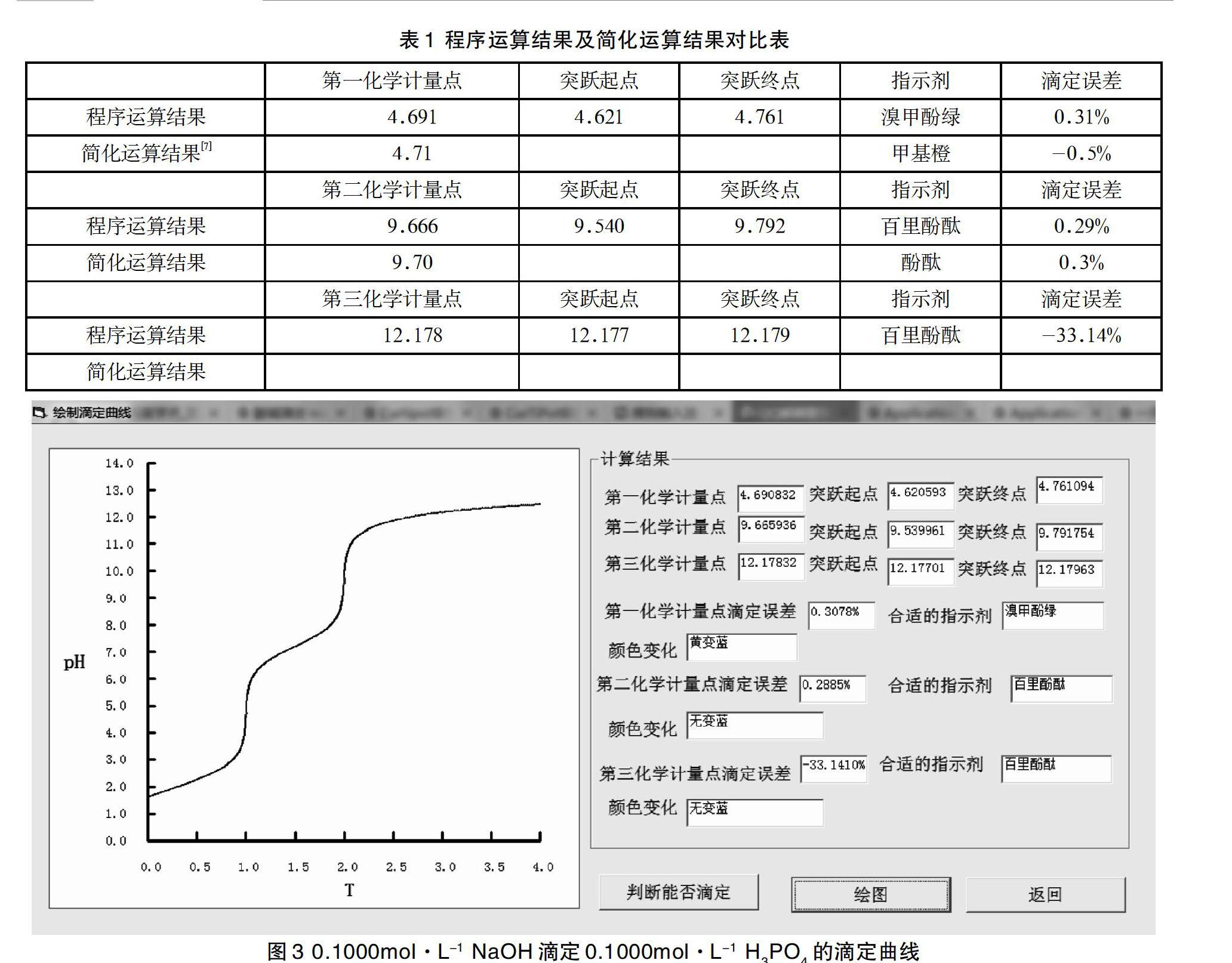
ホーム / みんなの自作式(科学) / 化学(一般) pHの計算mini(二価、三価、混合物) 多価酸、多価塩基、混合物の酸塩基滴定をシミュレーションします。 溶液Aを溶液Bで酸塩基滴定します。 酸価数はCOOHなど遊離酸の価数、塩基価数はNH2など遊離塩基混合液のpH計算 pH=6 と pH=9 の二つの水がある。これを 強酸と強塩基の混合水溶液のpH 1価の強酸(塩酸など)の水溶液に1価の強塩基(水酸化ナトリウム)の水溶液を加えると、速やかに中 和反応し、水溶液のpHは変化する。課題2 評価関数は pH の範囲で 0から14程度の間 に必ず f(H) = 0 の解があり、その両端で関数値が 逆の符号をもつ。このため、二分法で解くことが可能で ある。二分法により次のような条件での混合物のpHを 計算するプログラムを完成させる。




强酸和强酸混合速算法 强酸强碱混合ph计算 酸碱混合溶液ph计算




兩溶液混合後m之計算1 42閃 Youtube
のpH,す なわち,飽和KCI水 溶液と非水溶 液との問の液間起電力賜を含んで測定される見 掛上のpH,pH(X)convを 実測計算して見ると pH(X)convpH(S)=〓(211) となるここに,瓦 は液間起電力を含まないと 仮定したときの,上述の電池の起電力を示す 一方PH=-logH + であるからこれに代入すると pH=-log(1×10 12 )=-log10 12 =12 したがって、001mol/LのNaOH溶液のpHは12ということになります。



3 碱剩余 则计算剩余oh 浓度 计算ph值有宜宾哪些高中 高中课题目



强酸溶液的稀释与中和问题的定量分析 知乎



弱酸稀释后ph值的计算化学的ph值计算



Ph计算公式 文档之家




例題 Ph值與溶液稀釋 自然 均一教育平台




如何计算和混合化学溶液 科学 21




Ph值計算高中仟葉名師堂 高二化學 Yxhsa




酸鹼值計算ph值的計算方法 作業幫 Kmbymh




強酸と強塩基を混合した後のph計算問題




P H值計算



酸性及碱性的缓冲溶液的ph计算 化学自习室




Ph混合計算公式 Pdf



课件 教员分享 C4版 高二化学 人教版 选修四3 2 2 溶液ph的计算 课件 免费化学课件下载 优思教辅




電解質溶液中電離 水解 常數的相關計算




一般 Ph值與氫離子濃度 自然 均一教育平台




高中化學 溶液的ph計算 每日頭條




365 365bet官网 Com




Ph值計算 酸 Acidity 是測量h3o 濃度 Ph值 Log10 氫離子莫耳濃度 即ph Log H3o Ppt Download




Ph计算价格 Ph计算图片 星期三



新湧科技股份有限公司 專業的水工程專家 為節能減碳前瞻導航



腾讯视频




高中 請教一題有關ph值的計算 看板chemistry Ptt網頁版



二 缓冲溶液ph的计算
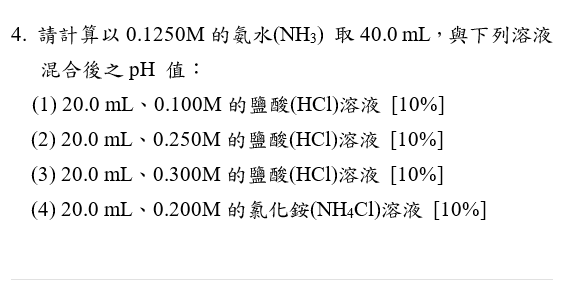



Its Mean 0 1250 Mole Nh3 Take 40 0ml To Mixture Chegg Com




Ph混合計算公式 Pdf



3 碱剩余 则计算剩余oh 浓度 计算ph值有宜宾哪些高中 高中课题目



Ph的计算方法与规律 化学自习室



1




第一节酸碱溶液的ph计算 Ppt Download




3种方法来计算溶液浓度



简单ph值的计算 西瓜视频搜索




血氣分析的判讀 壹讀




两混酸溶液的ph怎么算 两种弱酸混合求ph 弱酸与弱酸混合ph计算



调节ph加体积计算公式 Ph值加酸加碱计算公式 公式学习
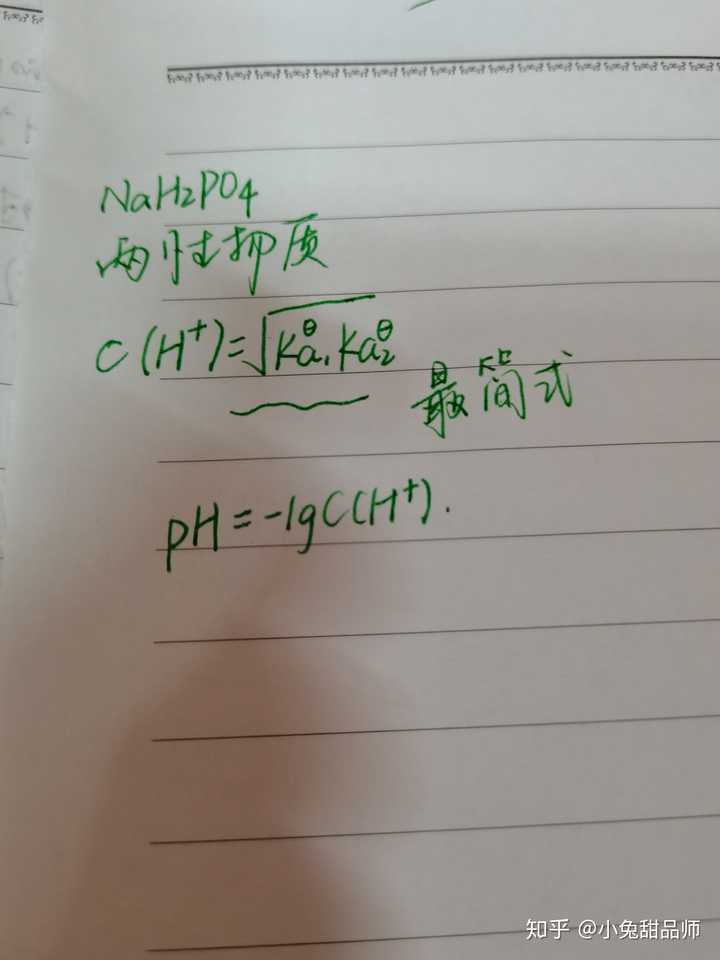



Ph计算公式 高中化学ph值计算公式 人体ph计算公式




6 U9178 U78b1 U6ef4 U5b9a U6cd5 Pdf U7b2c6 U8bb2 U9178 U78b1 U6ef4 U5b9a U6cd5 Acid Base Titrimetry 6 1 U9178 U78b1 U53cd U5e94 6 2 U6c34 U6eb6 U6db2 U4e2d U9178 U3001 U78b1 U7684 U5f3a U5ea6 6 3 Course Hero




P H值計算




第四章酸碱滴定法 4 1 酸碱质子理论 4 2 酸碱溶液ph的计算 4 3 酸碱滴定终点的指示方法 Ppt Download




Ph值計算混合高中化學 溶液的ph計算 Rlnew




21年高中化学高考最新精选试题 40道计算题 30道实验题 升学 恒艾教育



选修四 Ph的计算 混合溶液及稀释溶液 哔哩哔哩 Bilibili




弱酸弱碱混合ph怎么样计算 弱碱弱酸盐ph计算式 东煤网




人教版高中化学选修四 Ph的相关计算 Ppt课件 Macw视频素材库



Ph值怎么算 百度经验



如图 横坐标为溶液的ph 纵坐标为zn2 离子或zn Oh 42 离子物质的量浓度的对数 回答下列问题 1 往zncl2溶液中加入足量的氢 高中三年级 化学试题 离子反应考点 沉淀溶解平衡考点 溶度积常数考点 溶液 Ph的有关计算考点 好技网




Ppt Ph 计算习题课powerpoint Presentation Free Download Id



酸碱滴定反应的计算及模拟研究 参考网




Ppt Ph 计算习题课powerpoint Presentation Free Download Id



课件 教员分享 C4版 高二化学 人教版 选修四3 2 2 溶液ph的计算 课件 免费化学课件下载 优思教辅




的酸和碱的概念 Medicinus



课件 教员分享 C4版 高二化学 人教版 选修四3 2 2 溶液ph的计算 课件 免费化学课件下载 优思教辅




请问血液的ph值是如何计算的 血液ph值计算公式 蜂产网



混合溶液のphの問題がどうしてこの計算で解けるのか仕組みを詳しく教えてくださ Yahoo 知恵袋




将40ml0 mol Lhcl溶液同ml0 40mol L氨水混合 计算溶液的ph值怎么写 等浓度盐酸和氨水混合求ph 二安网



1



7 计算5 强碱和强碱混合ph值



混合两溶液后ph值计算的解题要领 化学原理补正 新浪博客




干货 溶液ph值计算小结 习题 教育频道 手机搜狐



硫酸ph值与浓度对照表 信息图文欣赏 信息村 K0w0m Com



Ap化学知识点之酸碱平衡中ph计算方法讲解 A加未来国际教育



1




混合溶液ph计算基本模板 附万能公式 方法大全 哔哩哔哩




1 3 2酸鹼反應19 酸鹼中和計算練習01 97指考 Youtube




第六题等体积混合后浓度是怎么变得呀 等体积混合浓度减半 丹若网




第二课时溶液ph的计算 Ppt Download




第三章电解质溶液




Phの計算が全くわかりません 教えてください Clear



高中化学选修三晶体的计算 视频在线观看 微短视频网




酸鹼度計算ph值是如何計算出來的 作業幫 Rjhi



Ph值的计算 文档库



强酸和强酸混合速算法 强酸强碱混合ph计算 酸碱混合溶液ph计算




两溶液混合ph计算技巧 搜狗搜索




18 19学年高中化学 期末复习备考 每日一题ph的计算及应用 含解析 新人教版选修4下载 Word模板 爱问共享资料




两性物质的ph计算公式两性动态图23式 百姓百科




Ph值怎么算 百度经验



緩衝溶液 定義及來源 緩衝原理 常見組成 Ph計算 配製方法 認識作用 中文百科全書



选修四 高中化学必备知识点 3 2 3溶液ph的计算 Gkhx



2




Ph的相关计算 人教版高二化学选修4ppt课件



Q Tbn And9gct2d0uy8gyggsk21wgj3emggpym85hnwnydt1gnc1koqvdeaof1 Usqp Cau




混合溶液ph计算基本模板 附万能公式 方法大全 哔哩哔哩




Ppt Ph 计算习题课powerpoint Presentation Free Download Id



腾讯视频




酸鹼值計算ph值的計算方法 作業幫 Kmbymh



混合溶液のphの計算問題なのですが 中和できずに余った水素イ Yahoo 知恵袋




4 4 2緩衝溶液33 緩衝溶液配製計算 Youtube



0 件のコメント:
コメントを投稿